پالادیوم
یا پالادیم از عنصرهای شیمیایی جدول تناوبی است. نشانه کوتاه آن Pd و عدد
اتمی آن ۴۶ است، و یکی از فلزات کمیاب است و به رنگ نقرهای و سفید
میباشد. پالادیوم از نظر شیمیایی همانند پلاتین بوده ولی پلاتین نیست و از
معادن مس و نیکل بدست میآید و در تهیه مبدلهای کاتالیست، کاتالیزورهای
صنعتی و همچنین جواهرات استفاده میشود.
تاریخچه
پالادیوم
در سال ۱۸۰۳ توسط "William Hyde Wollaston" کشف شد. این عنصر توسط
"Wollaston" دو سال بعد از کشف سیارک پالاس، نامگذاری شد. اسم این عنصر
برگرفته از الهه یونانی خرد، پالادیون یا پالاس است. Wollaston این عنصر را
در یک معدن پلاتین در آمریکای جنوبی کشف کرد. او این عمل را با حل کردن
مواد دریافت شده از معدن در محلول Aqua Regia و خنثی سازی محلول با اضافه
کردن هیدروکسید سدیم NaOH که با اضافه کردن mercuric Cyanide باعث تهنشین
شدن Ammonium Chloroplatinate و شکل گیری Palladium Cynide میشد، انجام
داد. وی در آخر با گرم کردن ترکیب بدست آمده، فلز پالادیوم را بدست آورد.
روزگاری
ترکیب کلریدپالادیوم برای درمان مرض سل به میزان ۰/۰۶۵ گرم در روز تجویز
میشد. این ترکیب، عوارض جانبی زیادی داشت و فوراً داروهای موثر دیگر
جایگزین آن شدند.
پیدایش
پالادیوم
هم به صورت فلز آزاد و هم به صورت آلیاژ با طلا و پلاتین و دیگر فلزات این
گروه در محل کوههای اورال استرالیا، اتیوپی و آمریکای شمالی و جنوبی یافت
میشود. با این حال، اکثر پالادیوم مصرفی بدلیل صرفه اقتصادی از معادن
نیکل و مس در آفریقای جنوبی و انتاریوی کانادا استخراج میشود، چرا که حجم
بالای فلزات تولید این معادن عمل دریافت پالادیوم را بهصرفه میکند.
ویژگیهای قابل توجه
پالادیوم
در مجاورت هوا سیاه نمیشود. این فلز با چگالی اندک خود، پایینترین نقطه
ذوب را در میان فلزات هم گروه پلاتینیوم دارد. این فلز در زمانی که به آن
حرارت داده شود، به میزان زیاده کشیده و نرم شده، در دمای سخت سفت و محکم
میشود. پالادیوم بهشدت با ترکیبات گوگردی و اسید نیتریک ترکیب شده،
بهآرامی در اسید هیدروکلریک حل میشود. همچنین این فلز در دماهای معمولی
با اکسیژن ترکیب نمیشود.
این
فلز به طرز بسیار غیر معمول و عجیب خاصیت جذب هیدروژن را تا ۹۰۰ برابر حجم
خود در شرایط مناسب (دمای ۸۰ درجه سانتیگراد و فشار ۱ اتمسفر) دارد.به نظر
میرسد که احتمالاً هیدرید پالادیوم را شکل میدهد: pd2H. اما هنوز ترکیب
شمیایی واقعی آن آشکار نیست.
حالتهای
معمولی اکسیداسیون پالادیوم +۲، +۳ و +۴ میباشد. اخیراً ترکیبات پالادیوم
که در آن، این عنصر اکسیداسیون +۶ دارد هم بوجود آمد.
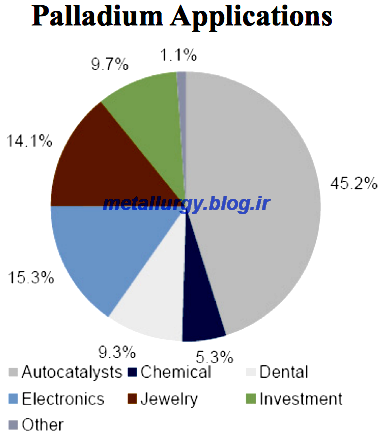
کاربردها
پالادیوم،
کاتالیزورهای خوبی را شکل داده، مخصوصا در عمل تصفیه نفت، سرعت
هیدروژنگیری و هیدروژنزدایی (Hydrogenation and Dehydrogenation) را زیاد
میکند. همچنین آلیاژ آن، در جواهرسازی استفاده میشود.

طلای سفید، آلیاژی از طلا بوده که با اضافه کردن پالادیوم، رنگ خود را از دست میدهد.
پالادیوم نیز همانند طلا میتواند به ورقههای نازک تبدیل شود.
هیدروژن بهراحتی در پالادیوم گرم شده منتشر میشود که در خالصسازی گازها کاربرد دارد.
در تجهیزات و سیستمهای سوییچینگ مخابراتی از پالادیوم استفاده میشود.
پالادیوم همچنین در دندانپزشکی، ساعت سازی و ساخت ابزار جراحی و اتصالات الکتریکی کاربرد دارد.
امروزه که میتوان تعداد همهی عنصرهای موجود در پوستهی زمین را کم و بیش با دقت تخمین زد، میتوان گفت که مقدار پالادیم در پوستهی زمین تقریباً 10 برابر مقدار طلاست. هر چند زمین شیمیدانان بیش از 30 کانی حاوی این عنصر را یافتهاند، اما همهی ذخایر پالادیم، مانند بقیهی فلزهای گروه پلاتین ، کمعیارنند (تنها پالادیم، طلای سفید ×5 درصد). پالادیم، بر خلاف سایر فلزهای گروه پلاتین، به طور طبیعی همراه پلاتین یافته می شود. معمولاً این فلز طبیعی با پلاتین، ایریدیم، طلا و نقره آمیخته است. غالباً پالادیم به صورت مخلوط با پلاتین طبیعی یا طلا دیده میشود. نوع بسیار کمیابی از طلای طبیعی (پروپزیت) حاوی 8 تا 11 درصد پالادیم در بزریل یافت شده است.
چون ته نشستهای حاوی پالادیم نسبتاً کمیاباند، مادهی خام اصلی برای استخراج آن، کانههای سولفیدی نیکل و مس است. البته در اینجا پالادیم نقش فروتنانهی فرآوردهای جنبی را به عهده دارد، اما این نکته از ارزش آن نمیکاهد. ترانسوال (در افریقای جنوبی) و کانادا دارای ذخایر سرشاری از این کانههایند. زمینشناسان روسیه ذخایر بزرگی از کانههای مس- نیکل را در ناحیه نوریلسک کشف کردهاند که حاوی فلزهای گروه پلاتین، و بویژه پالادیم است.
این عنصر در سایر اجرام سماوی نیز یافته میشود و وجود آن در شهابسنگها اثبات شده است: شهابسنگهای آهنی در هر تن 7ر7 گرم پالادیم دارند و در هر تن از شهابسنگهای سنگی 5ر3 گرم پالادیم یافت میشود. همه میدانند که بر سطح خورشید لکههایی هست، اما کمتر کسی میداندکه خورشید پالادیم نیز دارد. با این حال، وجود پالادیم در خورشید، به همراه ژلیوم در سال 1868 کشف شد.
پالادپالادیم که چگالی آن تقریباً 5ر1 برابر آهن است، در میان «همقطاران» خود، یعنی فلزهای گروه پلاتین، سبک وزن به شمار میرود: پالادیم با چگالی 12 گرم بر سانتیمتر مکعب، از اُسیُم ( 5 . 22 ) g/cm³ ایریدم (22.4) و پلاتین (21.45) بسیار عقبتر است. نقطهی ذوب این فلز نیز از سایر فلزهای گروه پلاتین کمتر، و برابر 1552 درجهی سلسیوس است. پالادیم حتی در دمای محیط نیز چکش خوار است. پالادیم در جواهر سازی به کار میرود، چون فلزی زیباست و خوب صیقل میخورد و کدر یا خورده نمیشود .
همه با این اصطلاحهای کلیشهای روزنامهها از قبیل «طلای سیاه» برای نفت، « طلای نرم» برای خز و «طلای سبز» برای جنگلها آشناییم. هنگامی که از «طلای سفید» سخن میرود منظور پنبه است. اما طلا هم میتواند ظاهراً سفید باشد: اگر مقدار ناچیزی پالادیم به طلا افزوده شود رنگ زرد آن را کاملاً زایل میکند و رنگ سفید زیبایی به آن میبخشد. ساعتها، دستبندها و جای نگینهایی که از طلای سفید ساخته میشوند زیبایی خیره کنندهای دارند.> همنشینی پالادیم با تیتانیم نتایج بسیار خوبی به بار آورده است. تیتانیم به سبب مقاومت بسیار خوب در برابر خوردگی معروف است: حتی « جانوران همه چیزخواری» همچون تیزاب سلطانی یا اسید نیتریک هم نمیتوانند «لقمهای» تیتانیم «بخورند». اما اسید سولفوریک و اسید کلریدریک غلیظ بر تیتانیم اثر میگذارند ولی اگر آن را با پالادیم « تقویت» کنیم (کمتر از یک درصد پالادیم)، توانایی تیتانیم برای مقاومت در برابر این تجاوزگران به شدت افزایش مییابد. در کارخانههای روسیه، این آلیاژ به منظور مصرف در صنایع شیمیایی، روغن سازی و هستهای تولید می شود. صفحهای ساخته شده از آلیاژ جدید پس از یک سال ماندن در اسید کلریدریک تنها 0.1 میلیمتر ضخامتش را از دست میدهد، در حالی که صفحهی ساخته شده از تیتانیم خالص، طی همین مدت بیش از 2 میلیمتر از ضخامت خود را از دست خواهد داد.
چرا پالادیم بر تیتانیم چنین تأثیری دارد؟ دلیل آن پدیدهی تازه کشف شدهی خود اثرناپذیری فلزهاست: افزودن مقدار ناچیزی از فلز های نجیب از قبیل پالادیم، روتنیم و پلاتین به آلیاژهای تیتانیم، آهن، کروم یا سرب، مقاومت آنها را صدها، هزارها و حتی دهها هزار برابر افزایش میدهد.
پژوهشگران آزمایشگاه خوردگی در انیستیتو شیمی فیزیک فرهنگستان علوم روسیه اثر افزودن پالادیم بر فولاد کرومدار را بررسی کردند. فولاد کرومدار در برابر بسیاری از اسیدها به سرعت تخریب میشود. هنگامی که چنین آلیاژی در محلولی اسیدی فروبرده میشود، یونهای مثبت آن در محلول پخش میشود؛ در همین حال، یونهای هیدروژن آزاد شده از محلول به درون شبکهی بلوری آلیاژی نفوذ میکنند و در آنجا، به سهولت با الکترونهای آزاد ترکیب میشوند. گاز هیدروژن تشکیل شده طی این فرآیند، فلز را تخریب میکند، هنگامی که به این فولاد اندکی (کسری از درصد) پالادیم افزوده شود، و آن را در محلول اسیدی قرار دهند، چند ثانیه پس از آغاز خوردگی، این واکنش متوقّف میشود. نتیجهی این بررسی نشان داد که اسید با پالادیم وارد واکنش میشود و لایهای نازک از اکسید بر روی سطح قطعه تشکیل میدهد و بعد گویی قطعه «لباسی» پوشیده است. فولادی که بدین صورت تقویت شده، عملاً نفوذناپذیر است: میزان خوردگی چنین فولادی در اسید سولفوریک گرم و جوشان از چند دهم میلیمتر در سال بیشتر نیست (فولاد معمولی طی همین مدت به اندازهی چند سانتیمتر خورده میشود)
پالادیم، خود از بسیاری از عنصرهای دیگر تأثیر میپذیرد. مثلاً افزودن برخی از فلزهای هم گروه آن، مثلاً روتنیم (4درصد) و رودیم (1 درصد)، استحکام کششی پالادیم را تقریباً دو برابر میکند.
آلیاژهای
پالادیم با سایر فلزها (به ویژه نقره) در دندان پزشکی مصرف میشوند (با
این آلیاژ میتوان دندانهای مصنوعی عالی ساخت). مهمترین نقطههای اتصال در
وسایل الکتریکی، تلفنها و سایر تجهیزات با پالادیم پوششکاری میشوند. با
استفاده از این فلز حدیدهها و تاوریسها (یا نخریسها)ی گوناگون ساخته
میشود. تاوریس کلاهکی است با روزنههای مختلف که برای تولید سیمهای بسیار
نازک یا الیاف مصنوعی به کار میرود، و مادهای را که به همین منظور آماده
شده است، با فشار از روزنههای آن عبور میدهند. از پالادیم در ترموکوپلها
و بعضی از تجهیزات پزشکی نیز استفاده می شود.
اما
جالبترین نکته دربارهی پالادیم، ویژگیهای شیمیایی بیهمتای آن است.
پالادیم برخلاف سایر عنصرهای شناخته شده در علم شیمی، در مدار بیرونی خود
18 الکترون دارد. به عبارت دیگر لایهی الکترونی آن کاملاً پر است، و به
همین سبب از لحاظ شیمیایی پایدار است. در شرایط عادی، اثر فلوئور قدرتمند
بر آن، بیشتر از اثر نیش پشه بر فیل نیست. تنها به کمک دمای زیاد (500
درجهی سلسیوس و بالاتر) است که فلوئور و دیگر اکسایندههای نیرومند
میتوانند با پالادیم واکنش کنند.
پالادیم
میتواند مقدار قابل توجهی گاز، و به ویژه هیدروژن، را جذب میکند (یا آن
گونه که فیزیکدانان و شیمیدانان گویند، برآشامد). در دمای محیط، هر
سانتیمتر مکعب پالادیم میتواند در حدود 800 حجم هیدروژن را در خود جذب
کند. البته چنین آزمایشی، بر فلز اثر میگذارد: فلز متورم میشود و ترک
میخورد.
ویژگی
دیگر پالادیم که آن هم به هیدروژن مربوط میشود، به همین اندازه اعجابآور
است. مثلاً اگر هیدروژن را با تلمبه به درون ظرفی از جنس پالادیم بفرستیم و
سپس ظرف را درزبندی و گرم کنیم، هیدروژن به همان سهولت که آب از غربال
میگذرد، از جدار ظرف به بیرون نفوذ میکند. در دمای 240 درجهی سلسیوس، از
هر سانتیمتر مکعب سطح جداری به ضخامت یک میلیمتر، 40 سانتیمتر مکعب
هیدروژن عبور میکند. با افزایش دما، تراوایی فلز از این هم بیشتر میشود.
پالادیم
نیز همچون دیگر فلزهای گروه پلاتین، کنشیار (کاتالیزور) بسیار خوبی است.
این ویژگی، همراه با توانایی آن در عبور دادن هیدروژن، پدیدهای را که به
تازگی گروهی از شیمیدانان مسکو کشف کردهاند، توجیه میکند. این پدیده شتاب
دو جانبهی دو واکنش در حضور یک کنشیار، در این مورد پالادیم، است. گویی
واکنشها به یکدیگر کمک میکنند، اما مادههای شرکت کننده در آنها با هم
مخلوط نمیشوند.
حال
فرض کنید ظرفی در اختیار داریم که با غشایی از جنس پالادیم به دو اتاقک
تقسیم شده است. یکی از این اتاقکها با بوتن ( پالادیم، طلای سفید) و دیگری
با بنزن ( پالادیم، طلای سفید) پر شده است. پالادیم که حرص شدیدی برای جذب
هیدروژن دارد، آن را از مولکولهای بوتن جدا میسازد، هیدروژن از غشای
پالادیمی عبور میکند، وارد اتاقک دیگر میشود، و به آسانی با مولکولهای
بنزن ترکیب میگردد. بوتن که هیدروژن از دست داده است، به بوتادین (مادهی
اولیه برای تولید لاستیک مصنوعی) تبدیل میشود، در حالی که بنزن، که
هیدروژن جذب کرده است، به سیکلوهگزان تبدیل میشود (از سیکلوهگزان برای
ساختن کاپرون و نایلون استفاده میکنند). ترکیب بنزن با هیدروژن تولید گرما
میکند. یعنی برای جلوگیری از توقف واکنش، باید پیوسته از آن گرما گرفت.
اما بوتن هیدروژن خود را تنها با گرما مبادله میکند. چون هر دو واکنش «زیر
یک سقف» انجام میشوند، گرمای ایجاد شده در اتاقک اول، در اتاقک دوم به
مصرف رسید . ترکیب مؤثر این فرآیند شیمیایی و فیزیکی را مدیون خاصیت
کنشیاری غشای پالادیم هستیم.
پالادیم، طلای سفید
به
کمک غشای پالادیم میتوان از نفت خام و گاز طبیعی، هیدروژن بسیار خالص به
دست آورد که در تولید نیمه رساناها و نیز فلزات بسیار خالص مورد نیاز است.
در
حال حاضر پالادیم چندان گرانبها نیست- بهای آن تنها یک پنجم بهای پلاتین
است. این نکته مهم است و امکان مصرف این فلز را هر سال افزایش میدهد.
یافتن کاربردهای جدید برای پالادیم را میتوان به کامپیوتر سپرد، به شرط
آنکه اطلاعات لازم به کامپیوتر داده شود تا بتواند «دربارهی آن فکر کند».
امروزه
دیگر کسی از شنیدن این که کامپیوترها شطرنج بازی میکنند، به کنترل
فرآیندهای تولید میپردازند، از زبانی به زبان دیگر ترجمه میکنند و
محاسبات مربوط به پروازهای هوایی را انجام میدهند، شگفت زده نمیشود. پس
چرا کامپیوتر نتواند آلیاژهایی جدید با خواص بیهمتا بیفزایند!
چنیدن
سال پیش، پژوهشگران مؤسسهی متالورژی بایکوف وابسته به فرهنگستان علوم
روسیه به این کار دست زدند. نخست الگوریتمهای مورد نیاز (زبان مشترکی که
ماشین دستورها را از طریق آن دریافت کند) تهیه شد. سپس دادههای مربوط به
تقریباً 1500 آلیاژ، بر اساس اطلاعات مربوط به فلزهای سازندهی آنها (مثلاً
ساختار اتمی، نقطه ذوب، نوع شبکهی بلورین و غیره)، به حافظه کامپیوتر
مینسک- 22 داده شد. این کامپیوتر وظیفه داشت بر اساس این دادهها پیش بینی
کند که چه ترکیبهای جدیدی از فلزات میتوان ساخت، و مشخصهی هر ترکیب را
شرح دهد تا بر اساس آن حوزهی کاربرد ترکیب جدید تعیین شود.
حال
تصور کنید انجام این کار در گذشته تا چه اندازه دشوار بود. پیش از این،
چنین کاری « با دست» یعنی بر اساس آزمایشهای استاندارد انجام میشد. در این
آزمایشها فلزی را انتخاب میکردند و مقداری از فلز دیگر را به آن
میافزودند، سرانجام نمونه را از لحاظ شیمیایی و فیزیکی بررسی میکردند. و
اگر ترکیب احتمالی، به جای دو، سه، از چهار، یا پنج عنصر تشکیل میشد،
آفریدن آلیاژی جدید از گذشتن از هفت خوان رستم دشوارتر بود. این کار سالها و
بلکه قرنها طول میکشید. تازه مقدار انبوه فلزهای مورد نیاز را، که بعضی
از آنها کمیاب و گرانبها هستند، در نظر نمیگیریم. ممکن است بعضی از این
فلزها، از قبیل انیم، ایندیم، یا پالادیم، به تعداد مورد نیاز برای این
آزمایشها در طبیعت وجود نداشته باشند.
بعلاوه،
«خوراک فکری» کامپیوتر را ارقام، نمادها و فرمولها تشکیل میدهند، در حالی
که از توان تولید بسیار بالایی برخوردار است و میتواند ظرف چند لحظه،
انبوهی از اطلاعات علمی را بررسی کند.
در
نتیجهی پژوهشهایی که ی. م. ساویتسکی عضو مکاتبهای فرهنگستان علوم روسیه
انجام داد ، پیش بینی و ساخت بعضی از آلیاژهای بیهمتا، به کمک کامپیوتر
ممکن شد.
در
میان نخستین آلیاژهای «کامپیوتر زاده» میتوان به آلیاژهای پالادیم،
بهویژه آلیاژ بنفش رنگ و فوقالعاده زیبای پالادیم با ایندیم اشاره کرد.
اما رنگ، مهمترین ویژگی آلیاژهای جدید نیست. مهمترین ویژگی این آلیاژها
کیفیت آنهاست. آلیاژی از پالادیم با تنگستن که به همین روش در مؤسسه
متالورژی بایکوف ساخته شد، قابلیت اطمینان و عمر بسیاری از ابزارهای
الکترونیکی را تا 20 برابر افزایش میدهد.
ساویستکی
نوشت: « بدیهی است که از پیش بینی کامپیوتری در مورد آلیاژهایی که میتوان
به سادگی با آمیختن چند فلز تولید کرد، استفاده نمیشود. اما هرگاه به
ترکیبهای پیچیدهای نیاز باشد که بتوانند در فشارهای بسیار زیاد و دماهای
بسیار بالا کار کنند و در برابر میدانهای مغناطیسی و الکتریکی از خود
مقاومت نشان دهند، کمک گرفتن از کامپیوتر اجتناب ناپذیر است.» تاکنون نزدیک
به 800 ترکیب ابررسانا و 1000 آلیاژ با ویژگیهای مغناطیسی خاص به وسیلهی
کامپیوتر پیشبینی شده است. گذشته از آن، کامپیوترها «پیشنهاد» کردهاند که
بر روی 5 هزار ترکیب از فلزهای خاکی کمیاب مطالعه شود؛ تنها یک پنچم از
این ترکیبها شناخته شدهاند. رهنمودهای ارزشمندی نیز دربارهی عنصرهای
ماورای اورانیوم داده شده است.
به
گفتهی ساویتسکی: «امکانات ترکیب کردن ترکیبهای غیرآلی نامحدود است. تا
چند سال آینده، تعداد ترکیبهایی که به این روش میتوان به دست آورد به دهها
برابر افزایش پیدا میکند. بدون تردید موادی با ویژگیهای شیمیایی و فیزیکی
نادر و کاملاً نو، که برای اقتصاد و تکنولوژی مدرن حیاتیاند، به دست
خواهد آمد.»
برای
حسن ختام سرگذشت پالادیم، از دو مدال تاریخی ساخته شده از این فلز سخن
میگوییم. نخستین مدال یک ونیم قرن پیش، به افتخار ولاستون، توسط انجمن
زمینشناسی لندن پایهگذاری شد. این مدال نخست از طلا ساخته میشد، اما پس
از آنکه جانسون، فلزشناس انگلیسی توانست پالادیم خالص را از پورپزیت برزیلی
استخراج کند، آن را از پالادیم ساختند. در سال 1943 مدال ولاستون به زمین
شیمیدان و کانیشناس برجستهی شوروی سابق، آکادمیسین فرسمان اعطا شد. دومین
مدال پالادیمی را که به پژوهشهای برجسته در الکتروشیمی و نظریهی
فرآیندهای خوردگی اختصاص دارد انجمن الکتروشیمی امریکا پایهگذاری کرده
است. در سال 1959 این مدال به الکتروشیمیدان برجستهی شوروی سابق،
آکادمیسین ا. ن. فرومکین اعطا شد.

