پالادیوم
یا پالادیم از عنصرهای شیمیایی جدول تناوبی است. نشانه کوتاه آن Pd و عدد
اتمی آن ۴۶ است، و یکی از فلزات کمیاب است و به رنگ نقرهای و سفید
میباشد. پالادیوم از نظر شیمیایی همانند پلاتین بوده ولی پلاتین نیست و از
معادن مس و نیکل بدست میآید و در تهیه مبدلهای کاتالیست، کاتالیزورهای
صنعتی و همچنین جواهرات استفاده میشود.
تاریخچه
پالادیوم
در سال ۱۸۰۳ توسط "William Hyde Wollaston" کشف شد. این عنصر توسط
"Wollaston" دو سال بعد از کشف سیارک پالاس، نامگذاری شد. اسم این عنصر
برگرفته از الهه یونانی خرد، پالادیون یا پالاس است. Wollaston این عنصر را
در یک معدن پلاتین در آمریکای جنوبی کشف کرد. او این عمل را با حل کردن
مواد دریافت شده از معدن در محلول Aqua Regia و خنثی سازی محلول با اضافه
کردن هیدروکسید سدیم NaOH که با اضافه کردن mercuric Cyanide باعث تهنشین
شدن Ammonium Chloroplatinate و شکل گیری Palladium Cynide میشد، انجام
داد. وی در آخر با گرم کردن ترکیب بدست آمده، فلز پالادیوم را بدست آورد.
روزگاری
ترکیب کلریدپالادیوم برای درمان مرض سل به میزان ۰/۰۶۵ گرم در روز تجویز
میشد. این ترکیب، عوارض جانبی زیادی داشت و فوراً داروهای موثر دیگر
جایگزین آن شدند.
پیدایش
پالادیوم
هم به صورت فلز آزاد و هم به صورت آلیاژ با طلا و پلاتین و دیگر فلزات این
گروه در محل کوههای اورال استرالیا، اتیوپی و آمریکای شمالی و جنوبی یافت
میشود. با این حال، اکثر پالادیوم مصرفی بدلیل صرفه اقتصادی از معادن
نیکل و مس در آفریقای جنوبی و انتاریوی کانادا استخراج میشود، چرا که حجم
بالای فلزات تولید این معادن عمل دریافت پالادیوم را بهصرفه میکند.
ویژگیهای قابل توجه
پالادیوم
در مجاورت هوا سیاه نمیشود. این فلز با چگالی اندک خود، پایینترین نقطه
ذوب را در میان فلزات هم گروه پلاتینیوم دارد. این فلز در زمانی که به آن
حرارت داده شود، به میزان زیاده کشیده و نرم شده، در دمای سخت سفت و محکم
میشود. پالادیوم بهشدت با ترکیبات گوگردی و اسید نیتریک ترکیب شده،
بهآرامی در اسید هیدروکلریک حل میشود. همچنین این فلز در دماهای معمولی
با اکسیژن ترکیب نمیشود.
این
فلز به طرز بسیار غیر معمول و عجیب خاصیت جذب هیدروژن را تا ۹۰۰ برابر حجم
خود در شرایط مناسب (دمای ۸۰ درجه سانتیگراد و فشار ۱ اتمسفر) دارد.به نظر
میرسد که احتمالاً هیدرید پالادیوم را شکل میدهد: pd2H. اما هنوز ترکیب
شمیایی واقعی آن آشکار نیست.
حالتهای
معمولی اکسیداسیون پالادیوم +۲، +۳ و +۴ میباشد. اخیراً ترکیبات پالادیوم
که در آن، این عنصر اکسیداسیون +۶ دارد هم بوجود آمد.
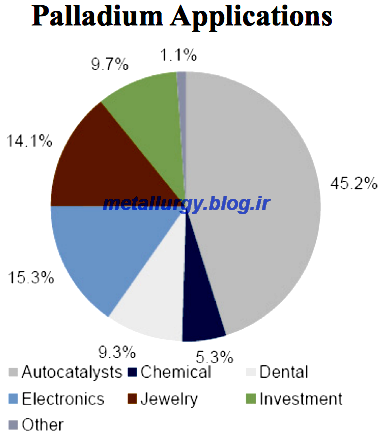
کاربردها
پالادیوم،
کاتالیزورهای خوبی را شکل داده، مخصوصا در عمل تصفیه نفت، سرعت
هیدروژنگیری و هیدروژنزدایی (Hydrogenation and Dehydrogenation) را زیاد
میکند. همچنین آلیاژ آن، در جواهرسازی استفاده میشود.

طلای سفید، آلیاژی از طلا بوده که با اضافه کردن پالادیوم، رنگ خود را از دست میدهد.
پالادیوم نیز همانند طلا میتواند به ورقههای نازک تبدیل شود.
هیدروژن بهراحتی در پالادیوم گرم شده منتشر میشود که در خالصسازی گازها کاربرد دارد.
در تجهیزات و سیستمهای سوییچینگ مخابراتی از پالادیوم استفاده میشود.
پالادیوم همچنین در دندانپزشکی، ساعت سازی و ساخت ابزار جراحی و اتصالات الکتریکی کاربرد دارد.
امروزه که میتوان تعداد همهی عنصرهای موجود در پوستهی زمین را کم و بیش با دقت تخمین زد، میتوان گفت که مقدار پالادیم در پوستهی زمین تقریباً 10 برابر مقدار طلاست. هر چند زمین شیمیدانان بیش از 30 کانی حاوی این عنصر را یافتهاند، اما همهی ذخایر پالادیم، مانند بقیهی فلزهای گروه پلاتین ، کمعیارنند (تنها پالادیم، طلای سفید ×5 درصد). پالادیم، بر خلاف سایر فلزهای گروه پلاتین، به طور طبیعی همراه پلاتین یافته می شود. معمولاً این فلز طبیعی با پلاتین، ایریدیم، طلا و نقره آمیخته است. غالباً پالادیم به صورت مخلوط با پلاتین طبیعی یا طلا دیده میشود. نوع بسیار کمیابی از طلای طبیعی (پروپزیت) حاوی 8 تا 11 درصد پالادیم در بزریل یافت شده است.
چون ته نشستهای حاوی پالادیم نسبتاً کمیاباند، مادهی خام اصلی برای استخراج آن، کانههای سولفیدی نیکل و مس است. البته در اینجا پالادیم نقش فروتنانهی فرآوردهای جنبی را به عهده دارد، اما این نکته از ارزش آن نمیکاهد. ترانسوال (در افریقای جنوبی) و کانادا دارای ذخایر سرشاری از این کانههایند. زمینشناسان روسیه ذخایر بزرگی از کانههای مس- نیکل را در ناحیه نوریلسک کشف کردهاند که حاوی فلزهای گروه پلاتین، و بویژه پالادیم است.
این عنصر در سایر اجرام سماوی نیز یافته میشود و وجود آن در شهابسنگها اثبات شده است: شهابسنگهای آهنی در هر تن 7ر7 گرم پالادیم دارند و در هر تن از شهابسنگهای سنگی 5ر3 گرم پالادیم یافت میشود. همه میدانند که بر سطح خورشید لکههایی هست، اما کمتر کسی میداندکه خورشید پالادیم نیز دارد. با این حال، وجود پالادیم در خورشید، به همراه ژلیوم در سال 1868 کشف شد.
پالادپالادیم که چگالی آن تقریباً 5ر1 برابر آهن است، در میان «همقطاران» خود، یعنی فلزهای گروه پلاتین، سبک وزن به شمار میرود: پالادیم با چگالی 12 گرم بر سانتیمتر مکعب، از اُسیُم ( 5 . 22 ) g/cm³ ایریدم (22.4) و پلاتین (21.45) بسیار عقبتر است. نقطهی ذوب این فلز نیز از سایر فلزهای گروه پلاتین کمتر، و برابر 1552 درجهی سلسیوس است. پالادیم حتی در دمای محیط نیز چکش خوار است. پالادیم در جواهر سازی به کار میرود، چون فلزی زیباست و خوب صیقل میخورد و کدر یا خورده نمیشود .
همه با این اصطلاحهای کلیشهای روزنامهها از قبیل «طلای سیاه» برای نفت، « طلای نرم» برای خز و «طلای سبز» برای جنگلها آشناییم. هنگامی که از «طلای سفید» سخن میرود منظور پنبه است. اما طلا هم میتواند ظاهراً سفید باشد: اگر مقدار ناچیزی پالادیم به طلا افزوده شود رنگ زرد آن را کاملاً زایل میکند و رنگ سفید زیبایی به آن میبخشد. ساعتها، دستبندها و جای نگینهایی که از طلای سفید ساخته میشوند زیبایی خیره کنندهای دارند.> همنشینی پالادیم با تیتانیم نتایج بسیار خوبی به بار آورده است. تیتانیم به سبب مقاومت بسیار خوب در برابر خوردگی معروف است: حتی « جانوران همه چیزخواری» همچون تیزاب سلطانی یا اسید نیتریک هم نمیتوانند «لقمهای» تیتانیم «بخورند». اما اسید سولفوریک و اسید کلریدریک غلیظ بر تیتانیم اثر میگذارند ولی اگر آن را با پالادیم « تقویت» کنیم (کمتر از یک درصد پالادیم)، توانایی تیتانیم برای مقاومت در برابر این تجاوزگران به شدت افزایش مییابد. در کارخانههای روسیه، این آلیاژ به منظور مصرف در صنایع شیمیایی، روغن سازی و هستهای تولید می شود. صفحهای ساخته شده از آلیاژ جدید پس از یک سال ماندن در اسید کلریدریک تنها 0.1 میلیمتر ضخامتش را از دست میدهد، در حالی که صفحهی ساخته شده از تیتانیم خالص، طی همین مدت بیش از 2 میلیمتر از ضخامت خود را از دست خواهد داد.
چرا پالادیم بر تیتانیم چنین تأثیری دارد؟ دلیل آن پدیدهی تازه کشف شدهی خود اثرناپذیری فلزهاست: افزودن مقدار ناچیزی از فلز های نجیب از قبیل پالادیم، روتنیم و پلاتین به آلیاژهای تیتانیم، آهن، کروم یا سرب، مقاومت آنها را صدها، هزارها و حتی دهها هزار برابر افزایش میدهد.
