
خوردگی در منیزیم و آلیاژهای آن
خوردگی
در منیزیم و آلیاژهای آن (Corrosion of Mg and Mg alloys) از مهمترین
مباحث کاربردی در باره این فلز است. منیزیم یکی از سبک ترین فلزات با چگالی
1.7 گرم بر سانتی متر مکعب و شبکه کریستالی شش وجهی می باشد. حدود 2% از
پوسته زمین از عنصر منیزیم تشکیل شده و آب دریا نیز یکی از منابع تقریباً
بی پایان آن می باشد. این عنصر در سال 1808 کشف شده است اما تا سال 1920
تنها کاربرد آزمایشگاهی داشت و در سالهای بعد با شناخته شدن روش های ذوب و
تصفیه ، آلیاژهای ریختگی آن گسترش و توسعه یافت.
مهمترین
مزیت و خاصیت منیزیم که موجب گسترش روزافزون استفاده از آن در صنایع مختلف
از جمله هوافضا، الکترونیک، حمل و نقل و اتومبیل شده است، نسبت استحکام به
وزن بالای آن می باشد. اما مقاومت به خوردگی نسبتا ضعیف آنها بویژه در
محیط های آب نمکی موجب محدود شدن استفاده از آنها گردیده است.
حضور
ناخالصی های فلزات سنگین و نجیب مثل آهن، نیکل و مس مؤثرترین عامل در کاهش
مقاومت به خوردگی آلیاژهای منیزیم می باشد که ناخالصی آهن مهم ترین بوده
و به مانند کاتالیزوری، تسریع کننده واکنش احیا می باشد.
فازهای
موجود در ریزساختار ونحوه توزیع آنها و همچنین انجام عملیات های مکانیکی،
شیمیایی و حرارتی مختلف می تواند اثرات متفاوتی بر رفتار خوردگی آلیاژهای
منیزیم داشته باشد. به خصوص در آلیاژهای ریختگی منیزیم –آلومینیوم، فاز β
موجود در ریزساختار اثر قابل توجه ای در مقاومت به خوردگی آلیاژ دارد.
منیزیم
در بیشتر محیط ها، به ویژه آنهایی که حاوی یون کلر می باشند ( آب دریا )
مقاومتی در برابر خوردگی ندارد. معمولاً زمانی که منیزیم در معرض محیطهای
آبی، کشاورزی و بیشتر محیطهای صنعتی قرار گیرد، فیلم اکسیدی تشکیل شده روی
آن، میتواند حفاظت قابل توجهی در برابر خوردگی اتمسفری فراهم آورد.
بنابراین خاصیت، مقاومت به خوردگی محیطی آلیاژهای منیزیم بهتر از فولادهای
نرم حتی در محیطهای آبی میباشد. عموماً سرعت خوردگی آلیاژهای منیزیم بین
آلومینیوم و فولاد نرم قرار قرار میگیرد. این فیلم سطحی تشکیل شده ساختار
هگزاگونال لایهای داشته که بین یونهای منیزیم و هیدروکسید متغیر است. ترک
خوردن و تاب برداشتن این فیلم در آزمایش ها مشاهده شده اما اینکه این
موضوع ناشی از خواص فیلم بوده و یا از آزاد شدن هیدروژن، کاملاً روشن نیست.
در اکثر محیطها ، فیلم سطحی عمدتاً از Mg(OH)2 تشکیل شده است اما بسته به
پتانسیل الکترود و pH محلول، فیلم محافظ می تواند MgO یا Mg(OH)2 باشد.
خوردگی
منیزیم بر اساس واکنشهای الکترو شیمیایی ساده بوده و حل شدن منیزیم در
محیطهای آبی، عموماً بر اساس واکنش الکتروشیمیایی با آب تا تولید
هیدروکسید منیزیم و گاز هیدروژن ادامه مییابد. خوردگی در محیط های آبی
اغلب به صورت کوپل های میکروگالوانیکی مابین سطح های آندی و کاتدی می
باشد.
واکنش کلی به صورت زیر بیان میگردد:
Mg + 2H2O → Mg(OH)2 + H2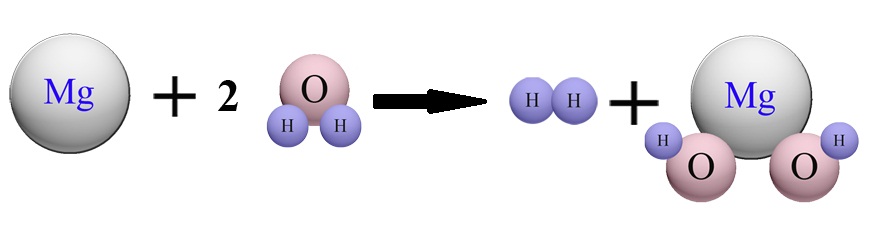
فرآیند
احیاء یون های هیدروژن و ولتاژ اضافی هیدروژن فاز کاتدی، نقش مهمی در
خوردگی منیزیم دارد. کاتدهای با ولتاژ اضافی پایین، آزاد شدن گاز هیدروژن
را آسان میکنند و موجب افزایش سرعت خوردگی میشوند.
همانطور
که در شکل زیر نشان داده شده است، منیزیم و آلیاژهای آن دارای کمترین
پتانسیل استاندارد نسبت به سایر فلزات و آلیاژهای مهندسی میباشد .در 25
درجه سانتی گراد پتانسیل استاندارد الکترود منیزیم برابر با 2.3 - ولت
میباشد که این عدد، در مورد منیزیم آزاد در تماس با محلول حاوی منیزیم دو
ظرفیتی میباشد اما در محلولهای قلیایی پتانسیل 2.69 - ولت میباشد.
انواع خوردگی در منیزیم و آلیاژهای آن
انواع
مختلفی از پدیده خوردگی در منیزیم و آلیاژهای آن رخ می دهد که بسته به
شرایط محیطی و قطعه دارد. در ذیل بعضی از انواع آن آورده شده است:
1- خوردگی گالوانیکی
2- خوردگی موضعی
3- حفره دار شدن
4- خوردگی شیاری
5- خوردگی رشته ای
6- خوردگی تنشی
7- خوردگی بین دانه ای
8- خوردگی دما بالا
خوردگی گالوانیکی در منیزیم
آلیاژهای
منیزیم بسیار مستعد خوردگی گالوانیکی هستند. در جدول سری الکتروموتیوی،
منیزیم در پتانسیلهای فعال قرار داشته و لذا هنگامی که با فلزات نجیب تر
از خود کوپل می شود دچار خوردگی گالوانیکی می گردد. برای کوپل آلیاژهای
منیزیم با سایر فلزات رابطه زیر طبق قانون دوم کیرشهف، رابطه زیر وجود دارد
:
γc –γMg = i (Re +Rm)
γc : پتانسیل پلاریزاسیون کاتد( فلز غیر مشابه)
γMg : پتانسیل پلاریزاسیون آند ( آلیاژ منیزیم)
Re : مقاومت الکترولیت
Rm : مقاومت مربوط به بخشهای مختلف مدار پیل
Rm معمولا کوچک و قابل صرف نظراست.
خوردگی
گالوانیکی معمولا به صورت خوردگی موضعی شدید منیزیم ( به عنوان آند) در
کنار کاتد دیده میشود. کاتدها میتوانند خارجی باشد ( منیزیم در تماس با
سایر فلزات) و یا ممکن است داخلی باشد ( فازهای ثانویه یا نا خالصی). این
دو نوع خوردگی در شکل زیر نشان داده شده است.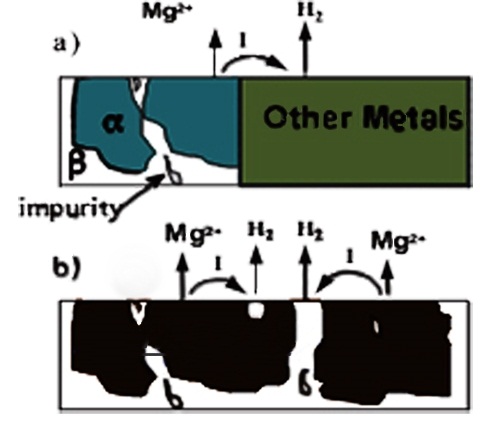
a) خوردگی گالوانیکی خارجی
b) خوردگی گالوانیکی داخلی
فلزات
در ترکیب با منیزیم تاثیرات متفاوتی بر رفتار خوردگی آن دارند. تأثیر
گالوانیکی آلیاژهای آلومینیوم بر منیزیم عموماً کم میباشد. در اتمسفرهای
روستایی، شهری و صنعتی هیچ یک از آلیاژهای تجاری آلومینیوم سبب خوردگی
گالوانیکی منیزیم و آلیاژهای آن نمیشود اما در آب دریا و یا در محلول
کلرید سدیم اثرات جزیی خوردگی گالوانیکی مشاهده میشود. فلزاتی که دارای
ولتاژ اضافی هیدروژن کم می باشند مانند نیکل، آهن و مس، کاتدهای مؤثری بوده
و موجب خوردگی شدید منیزیم میشوند.
میزان
خوردگی منیزیم در کوپل گالوانیکی به مقدار اختلاف پتانسیل منیزیم با فلز
کوپل شده در جدول الکتروموتیوی بستگی دارد. مکانیزم پلاریزاسیون کوپل
منیزیم در محلول آب نمک توسط آزاد سازی هیدروژن در کاتد کنترل میشود، لذا
فلزات با ولتاژ اضافی هیدروژن پایین مانند نیکل، آهن و مس، کاتدیهای
موضعی جهت آزادسازی هیدروژن را ایجاد می کنند ودر نتیجه موجب تشدید خوردگی
گالوانیکی میگردند و فلزاتی که ولتاژ اضافی هیدروژن بالاتری دارند مانند
آلومینیوم، روی و کادمیم اثر تخریبی کمتری داشته اگرچه کاملاً هم با منیزیم
سازگار نمیباشند.
یکی
از مهم ترین عوامل موثر بر میزان خوردگی گالوانیکی، مساحت نسبی آند
(منیزیم) و کاتد ( فلز غیر مشابه) است. یک کاتد بزرگ کوپل شده با سطح کوچکی
از منیزیم سبب انحلال سریع منیزیم میگردد، زیرا چگالی جریان گالوانیکی در
آند کوچک، بسیار بالا بوده و موجب محدود شدن پلاریزاسیون آندی در
محلولهای کلریدی میگردد. این مسئله در آلیاژهای منیزیم رنگ شده، مشاهده
شده است، که در آنها یک ترک کوچک در پوشش ( در محل اتصال ) موجب ایجاد
دانسیته جریان گالوانیکی بزرگی در منطقه مذکور شده است.
شکل زیر خوردگی گالوانیکی در قسمت قنداق تفنگ ww ΙΙ ایتالیایی که به مدت 45 سال در اتمسفر باز قرار داشته است را نشان می دهد.
خوردگی گالوانیکی
جهت پیشگیری از خوردگی گالوانیکی آلیاژهای منیزیم ملاحظات زیر پیشنهاد شده است:
·طراحی مناسب جهت جلوگیری از حبس شدن آب نمک در محل اتصال منیزیم با فلزات غیر مشابه
·افزایش مقاومت در بخش فلزی مدار توسط عایق ها یا در داخل الکترولیت مدار توسط افزایش طول {{مدار}} الکترولیتی
·انتخاب سازگارترین فلز غیر مشابه با منیزیم
·استفاده از پوششهای حفاظتی روی کل اتصالات
هدایت و رسانایی محیط، فاصله کم بین آند و کاتد و قابلیت پلاریزاسیون کم آند و کاتد نیز بر میزان سرعت خوردگی گالوانیکی مؤثر است.
خوردگی موضعی در منیزیم
این
نوع خوردگی به شکلهای حفره دار شدن، شیاری و رشته ای ایجاد میشود.
خوردگی بین دانهای نیز با توجه به ساختار متالورژیکی می تواند نوعی
خوردگی موضعی در نظر گرفته شود.
حفره دار شدن ( Pitting ) در منیزیم
خوردگی
حفره دار شدن (Pitting) معمولترین نوع خوردگی مشاهده شده در آلیاژهای
منیزیم میباشد. منیزیم طبیعتاً فلزی غیرفعال بوده و زمانی که در پتانسیل
آزاد خوردگی خود ، Ecorr، در معرض یونهای کلریدی و در محیط غیر اکسیدی
قرار میگیرد، خوردگی حفره دار شدن در آن رخ میدهد. در نتیجه میتوان گفت،
خوردگی آلیاژهای منیزیم در محلولهای نمکی و قلیایی به شکل حفره دار شدن
می باشد. غلظت یون کلر بیشترین تأثیر را در شروع و اشاعه حفرهها در سطح
آلیاژهای منیزیم دارد.
این
نوع خوردگی، سبب جدایش و تورم مناطقی از سطح گشته که در نتیجه آن،
کریستالهای منیزیم به همراه محصولات خوردگی جدا می شود. در ادامه، خوردگی
در این نوع نواحی پیش رفته و سبب ایجاد حفره هایی نامنظم می گردد که به
مرور زمان بزرگتر می شوند. آلوده شدن با فلزات سنگین موجب تشدید حفره دار
شدن عمومی میگردد. شکل زیر شماتیک حفره دار شدن را نشان می دهد.
حفره دار شدن
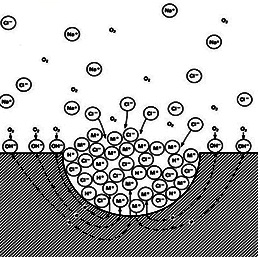
در
شرایط صنعتی معمول، خوردگی یکنواخت است اما در شرایط غوطه وری به صورت
نامنظم است چون بعضی نواحی نسبت به بقیه آندی تر شده و در آن نواحی حفره
دار شدن اتفاق میافتد . شکل زیر سطح حفره دار شده آلیاژ منیزیم را نشان می
دهد.
حفره دار شدن
خوردگی شیاری در منیزیم
پدیده
خوردگی شیاری در اثر گسترش یافتن یک ناحیه آندی در محل شیار و ممانعت از
ورود اکسیژن به آن و وجود یک ناحیه کاتدی بیرون از محل شیار که غلظت اکسیژن
در آن بالاست، رخ می دهد. مکانیزم این خوردگی بر اساس تشکیل پیل های
غلظتی کاتیونی و آنیونی می باشد. به علت آنکه منیزیم به تفاوت غلظتی
اکسیژن چندان حساس نمی باشد این نوع خوردگی در آن کمتر اتفاق می افتد.
خوردگی رشتهای در منیزیم
خوردگی
رشته ای در اثر حرکت یک سلول خوردگی فعال در سطح فلز از سویی به سوی دیگر
ایجاد شده که سر رشته آند و انتهای آن کاتد می باشد. این نوع خوردگی در
زیر لایههای آبکاری و پوششهای محافظ اتفاق میافتد که شماتیک آن در شکل
زیر نشان داده شده است. آلیاژ های منیزیم رنگ شده، وقتی در معرض هوای مرطوب
قرار میگیرند و یا زمانی که در محلول کلریدی کاملا غوطه ور میشوند ممکن
است دچار خوردگی رشته ای شوند.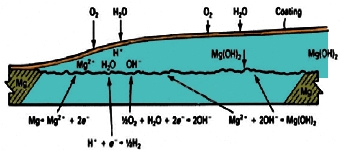
خوردگی مرزدانهای در منیزیم
این
نوع خوردگی در آلیاژهای منیزیم بسیار کم اتفاق میافتد و تنها در محلول
اسید کرومیک حاوی مقادیر جزیی یون کلر یا سولفات، تمایل اندکی به خوردگی
دانه ای نشان می دهند.
در
این نوع خوردگی، فازهای مرز دانه نسبت به داخل دانه کاتدی بوده و در
نتیجه خوردگی روی دانهها متمرکز می شود و اجزای مرز دانه نه تنها به
خوردگی مقاوم تر هستند بلکه به صورت کاتدی به وسیله دانه همسایه محافظت می
شوند.
خوردگی تنشی (SCC ) در منیزیم
وجود
تنشهای کششی پسماند حاصل از فرایندهای تولید، موجب ایجاد SCC و شکست در
زمان بهره برداری میگردد. این نوع خوردگی در آلیاژهای منیزیم معمولا درون
دانه ای بوده و شاخه شاخه شدن ترک در آن به خوبی دیده میشود. معمولا
قطعات ریختگی نسبت به محصولات کار شده[1] با ترکیب یکسان، حساسیت کمتری به
SCC دارند. آلیاژهای اکسترود شده AZ61H و AZ80A شدیدا نسبت به SCC حساس
بوده و آلیاژهای ریختگی با 10-6 % آلومینیوم، حساسیت کمتری داشته و
آلیاژهای ریختگی AZ31B و ZK51B ایمن به نظر میرسند.
افزودنیهای
آلیاژی مثل آلومینیوم و روی، موجب گسترش SCC می شوند و افزودن قلع بهبودی
اندکی را به همراه دارد. در واقع آلیاژهای Mg-Al نسبت به همه آلیاژهای
منیزیم حساسیت بیشتری به خوردگی تنشی داشته و با افزایش مقدار آلومینیوم
این حساسیت بالا میرود. در شکل زیر نمونه ای از SCC ایجاد شده در آلیاژ
AZ91 دیده می شود.
خوردگی تنشی
منیزیم
خالص نسبت به SCC حساس نیست. آلیاژهای Mg-Zn حساسیت متوسطی داشته و
آلیاژهایی که نه حاوی روی و نه آلومینیوم هستند، مقاومترین نوع آلیاژ به
SCC هستند. عموماً پس از عملیات جوشکاری، جهت حذف احتمال ایجاد خوردگی تنشی
ناشی از تنشهای پسماند، عملیات تنش زدایی بر روی آلیاژهای منیزیم حاوی
آلومینیوم صورت میپذیرد.
به
نظر میرسد که در محیطهای قلیایی با PH>10.2 ، آلیاژهای منیزیم نسبت
به خوردگی تنشی مقاوم هستند. در محلولهای خنثی حاوی کلریدها و حتی در آب
مقطر، حساسیت به ترک خوردن وجود دارد و در آخر اینکه، آلیاژهای منیزیم در
محلولهای فلوئورید یا حاوی فلوئورید نسبت به SCC مقاوم هستند.
خوردگی خستگی در منیزیم
وجود
محیط خورنده میتواند تنش متناوب قابل تحمل را در فرآیند خستگی کاهش دهد.
تحقیقات اندکی روی خوردگی خستگی آلیاژهای منیزیم صورت گرفته است و دیده شده
که، شیب منحنی خستگی با محیط خورنده و ترکیب آلیاژ تغییر میکند. این
آلیاژها در هوای خشک، حد خستگی نشان داده و استحکام خستگی آنها در
محلولهای آب نمک یا آب مقطر، کمتر از استحکام خستگی آنها در هوا میباشد.
شکل زیر شماتیک اثر محیط خورنده را بر طول عمر خستگی نشان می دهد.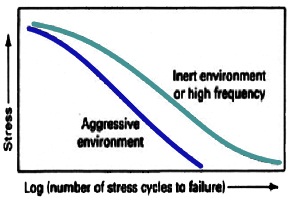
خوردگی دما بالای منیزیم
در
دماهای بالا و در حضور اکسیژن، سرعت اکسیداسیون منیزیم تابع خطی از زمان
بوده که نشان دهنده وجود اکسید غیر محافظ روی سطح منیزیم است. با افزایش
دما سرعت اکسیداسیون به طور قابل ملاحظهای افزایش مییابد. بیشتر عناصر
آلیاژی مثل آلومینیوم و روی، سرعت اکسیداسیون را بالا می برند.
